Содержание:
Человек, столкнувшийся с диагнозом рак, постоянно находится в тесном контакте с врачом. Построение доверительных отношений между пациентом и доктором — важная составляющая успеха в борьбе с онкологическим заболеванием. Однако зачастую человеку без специального образования сложно понять, о чем говорит специалист.
В рамках онкофорума «Белые ночи» эксперты ведущих российских клиник провели сессию для пациентов, во время которой рассказали о значении сложных медицинских терминов.
Ишматова Ирина Валерьевна, врач-гематолог отделения гематологии и химиотерапии с палатой реанимации и интенсивной терапии НМИЦ онкологии им. Н.Н. Петрова, подробно разъяснила термины, используемые докторами при лечении онкогематологических заболеваниях.

Что такое лимфома?
Лимфома – это злокачественное заболевание лимфатической системы, в результате которого происходит увеличение лимфатических узлов и появление очагов во внутренних органах, зачастую не относящихся к лимфатической системе, из-за накопления в них опухолевых лимфоцитов. Лимфатическая система включает в себя:
- лимфатические капилляры,
- сосуды,
- протоки,
- лимфатические узлы,
- органы, такие как селезенка и вилочковая железа, то есть тимус.
Лимфоцит – это клетка лейкоцитарного ряда, которая в своем здоровом состоянии участвует в формировании иммунного ответа, в том числе противоопухолевого иммунитета. Лимфоциты делятся на 2 большие группы:
- В-лимфоциты — участвуют в выработке антител специальных биологических веществ, направленных на инактивацию(устранение) чужеродных бактерий, вирусов и микроорганизмов.
- Т-лимфоциты — это киллеры, прямые цитотоксические клетки, способные уничтожать вирусные клетки. В составе Т-лимфоцитов есть группа клеток, обладающих иммуносупрессивным действием, то есть эти клетки подавляют избыточную реакцию иммунитета. Таким образом эти клетки профилактируют аллергические состояния.
Лимфомы — это большая и очень разнообразная группа заболеваний, принципиально делящееся на две большие группы:
- Лимфома Ходжкина — встречается с частотой 40% среди всех случаев лимфом;
- Неходжкинские лимфомы — встречаются с частотой 60% среди всех случаев лимфом.
Неходжкинские лимфомы названы и классифицированы в соответствии с уровнем, на котором произошло повреждение лимфоцита на этапе созревания и дифференцировки (приобретением клетки определенного свойства).
Если «поломка» произошла на уровне клетки предшественницы в костном мозге –появляется риск возникновения таких заболеваний, как острый лейкоз.
Если клетка уже вышла из костного мозга, попала в кровоток и в последствии оказалась в лимфатическом узле, где и произошла «поломка», то провоцируется возникновение лимфом.
В зависимости от того на каком этапе происходит мутация в лимфоците, лимфома получает определенное название: лимфома Беркитта, диффузная В-клеточная крупноклеточная лимфома, фолликулярная лимфома, лимфома Ходжкина, лимфоплазмоцитарная лимфома и другие.
Краткий справочник:
- VDJrecombination – перестройка ДНК клетки-родоначальника лимфоцита;
- MCL – лимфома из клеток зоны мантии;
- CLL/SLL – хронический лимфолейкоз/лимфома из алых лимфоцитов;
- SHM/CSR – соматическая гипермутация/переключение классов антител;
- BL – лимфомаБёркитта;
- DCBCL – диффузная В-клеточная крупноклеточная лимфома;
- FL – фолликулярная лимфома.
Стадирование лимфом
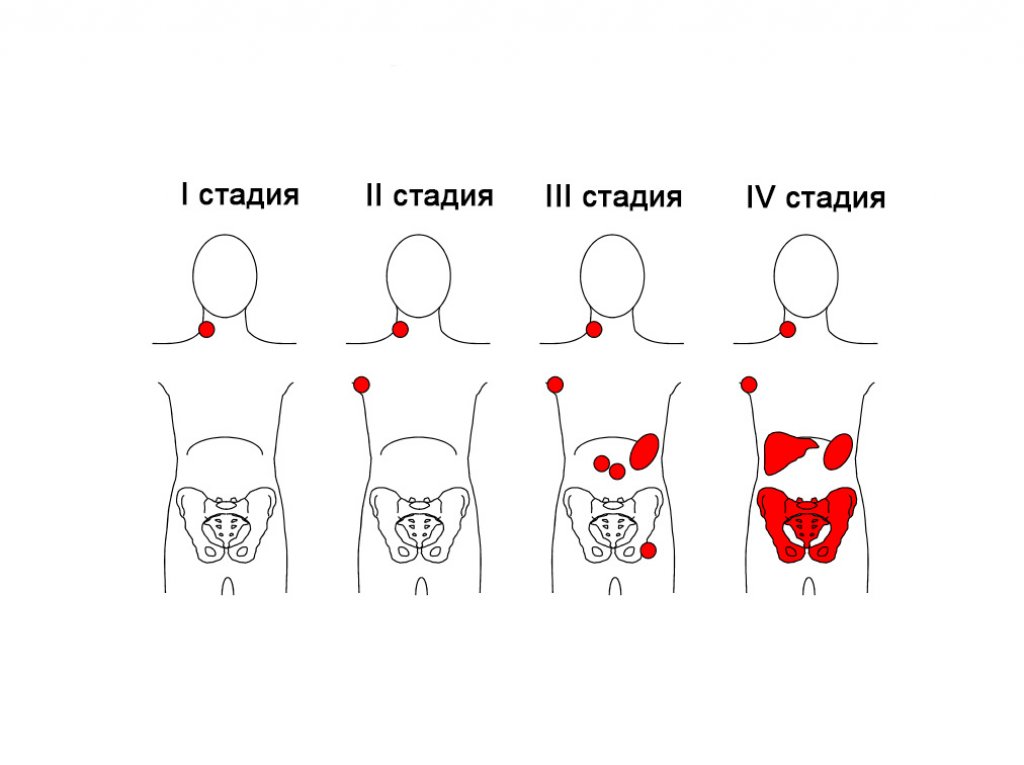
Стадирование лимфом— это оценка распространенности заболевания.
Для оценки используется несколько систем стадирования, наиболее распространенная —Ann-Arbor. Она основана на принципе локализации (расположения) и объема опухоли:
- 1 стадия – поражение одной лимфатической области;
- 2 стадия – поражение более чем одной лимфатической области, но по одну сторону от диафрагмы (мышца, которая условно делит тело на верхнюю и нижнюю части);
- 3 стадия – поражение лимфатических узлов выше и ниже диафрагмы и/или селезенки;
- 4 стадия – поражение не только лимфатических узлов, но и нелимфатических органов, таких как печень, почки, легкие и костный мозг.
Система стадирования не включает в себя ряд таких важных показателей, как количество лейкоцитов, лимфоцитов, гемоглобина или альбумина. Поэтому в помощь врачу были придуманы прогностичексие международные индексы, различные для лимфомы Ходжкина и неходжкинских лимфом. Эти индексы помогают специалисту определиться с количеством и интенсивностью курсов химиотерапии.
Как установить распространенность рака? ПЭТ-КТ с 18-фтордезоксиглюкозой
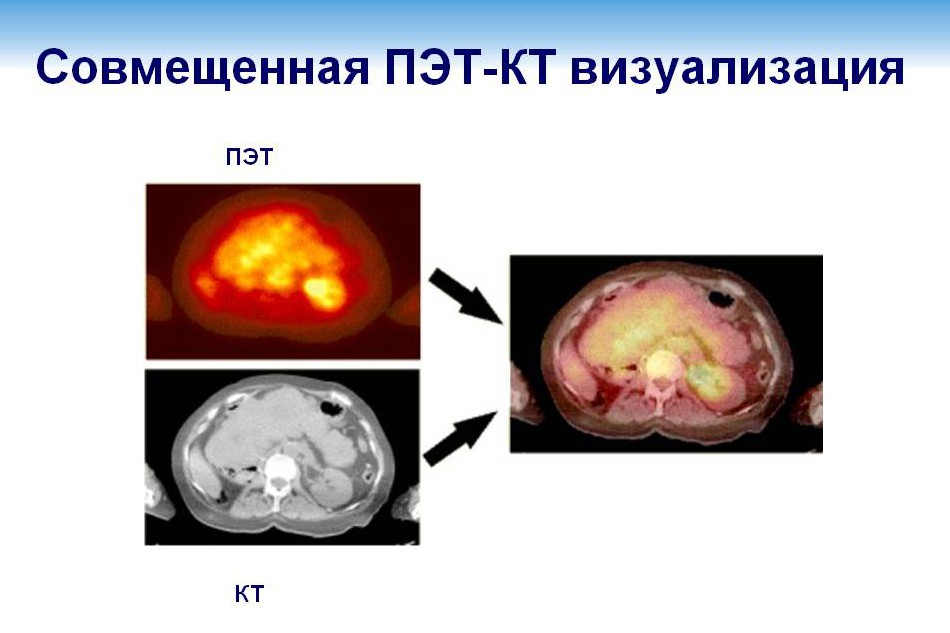
Для визуализации болезни используется позитронно-эмиссионная томография (ПЭТ). Этот метод исследования основан на применении радиофармпрепарата. При визуализации лимфопролиферативных заболеваний используется фтордезоксиглюкоза, при других заболеваниях используются иные радиофармпрепараты.
Специалист видит распространение радиофармпрепарата в тканях организма за счет свечения разной интенсивности. Свечение вызывает некоторое «размывание» контуров лимфатического узла или очага в органе, поэтому позитронно-эмиссионную томографию (ПЭТ) зачастую совмещают с компьютерной томографией (КТ) с применением внутривенного контрастирования. Это позволяет четче визуализировать структуру и размер очага.
Что такое острый лейкоз?
Острый лейкоз – это очень агрессивное заболевание, в основе которого лежит мутация, произошедшая в стволовой клетке или коммитированных клетках-предшественницах гемопоэза (процесса кровотворения). Таким образом клетка ускользает из-под контроля, начинает очень быстро делиться и заполняет весь костный мозг, мешая нормальным здоровым клеткам-предшественницам производить клетки периферической крови: эритроциты, тромбоциты и лейкоциты.
С прогрессированием опухолевые клетки, которые называются бласты, могут мигрировать из костного мозга и оставлять свои депозиты в разных других органах: легких, почках, кишечнике и в центральной нервной системе.
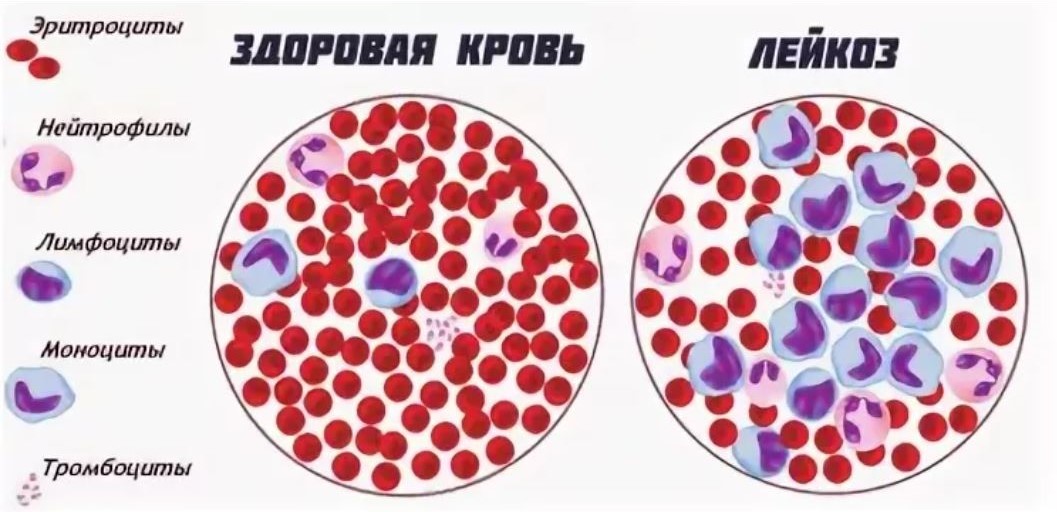
На картинке можно увидеть кровь здорового человека – она красная и в ней много эритроцитов. Соотношение эритроцитов и лейкоцитов обычно 3 к 1, то есть эритроцитов всегда больше. Рядом микроскопическая картина крови пациента с лейкозом – здесь можно увидеть, что там очень много незрелых молодых клеток-бластов, численно преобладающих над эритроцитами.
Как диагностировать острый лейкоз? Биопсия
Чтобы установить диагноз острый лейкоз, достаточно получить образец костного мозга методом аспирационной биопсии. С помощью иглы, установленной в подвздошную кость, специалист собирает около миллилитра жидкой части костного мозга, после чего образец наносится на предметное стекло, фиксируется, красится, и доктор-морфолог описывает состояние клеток в костном мозге.
В некоторых случаях жидкую часть костного мозга получить невозможно, тогда специалисты используют трепанобиопсию – это способ получить фрагмент костного мозга вместе с костно-мозговыми пространствами, гемопоэтическими клетками и клетками микроокружения.
Если говорить о вариантах биопсии, используемых в диагностике лимфопролиферативных заболеваний, то используется эксцизионная биопсия лимфатического узла, при которой лимфоузел извлекают целиком. В ряде случаев это сделать проблематично, например, когда лимфоузел расположен на кровеносном сосуде или интимно спаен с капсулой какого-то органа. Такая биопсия может повлечь за собой развитие кровотечения, поэтому есть компромиссный вариант — инцизионная биопсия, то есть биопсия кусочка какого-то лимфоузла или очага, расположенного в любом из органов.
Гистологическое заключение. Что такое CD-ландшафт клеток?
Гистологическое заключение — это букв и цифр, разобраться в которых порой непросто даже врачам. Стоит объяснить некоторые обозначения.
Каждая клетка на своей поверхности имеет кластеры дифференцировки, которые записываются английской аббревиатурой CD. Это белки, служащие лигандами или рецепторами для формирования клеточных взаимодействий. По ним клетки узнают друг друга, могут связываться друг с другом, передавать сигналы и запускать каскад реакций – например, иммунных. Это своего рода паспорт клетки. На изображении представлен здоровый Т- и В-лимфоцит со своими презентирующими молекулами.
Опухолевая клетка тоже имеет свой паспорт. На ее поверхности презентированы сложные белковые молекулы, которые позволяют врачу-гистологу с помощью специальных иммунных красок распознать клетку и оценить этап созревания лимфоцита, на котором произошло какое-то событие, изменившее жизнь клетки.
В зависимости от того, где происходит мутация, клетка презентирует определенные белки, а затем врач-гистолог оценивает степень созревания клетки и ставит определенный диагноз.
Что такое иммуногистохимия?
Иммуногистохимическое исследование – это исследование тканей на предмет наличия в них определенных молекул. Чтобы обнаружить искомые молекулы, специалисты с помощью биопсии берут у пациента фрагмент ткани опухоли. Далее на биоматериал наносятся реагенты, а именно – антитела к молекуле-мишени. Если в ткани присутствует молекула-мишень, то она вступает в реакцию с антителом и происходит окрашивание. Специалист рассматривает фрагменты ткани под микроскопом и оценивает результат.
Иммунофенотипирование — методика, позволяющая узнать, какие белки представленные на поверхности клеток. Чаще всего используется для диагностики острых лейкозов, а также позволяет определить происхождение бластов и степень их созревания. В диагнозе данные значения оформляются римскими или арабскими цифрами. Это аппаратная методика, которая на картинках выглядит в виде скоплений клеток в системе координат.
Что показывают генетические исследования? Зачем их проводить?
В наши дни генетические исследования проводятся для формирования стратификации рисков, для определения, в том числе, необходимости проведения трансплантации костного мозга в первой линии терапии.
Это очень важное исследование, и его необходимо проводить на этапе первичного обследования пациента.
На примере хронического миелолейкоза впервые была показана связь злокачественного заболевания с конкретной генетической аномалией.
В случае хронического миелолейкоза такой характерной аномалией является хромосомная транслокация, которая проявляется присутствием в кариотипе (генетическом наборе человека) так называемой филадельфийской хромосомы. Эта мутантная хромосома получила своё название по месту работы её первооткрывателей, Питера Ноуелла (Пенсильванский университет) и Дэвида Хангерфорда (Онкологический центр Фокса Чейза), которые впервые описали её в 1960 году в Филадельфии (штат Пенсильвания, США).
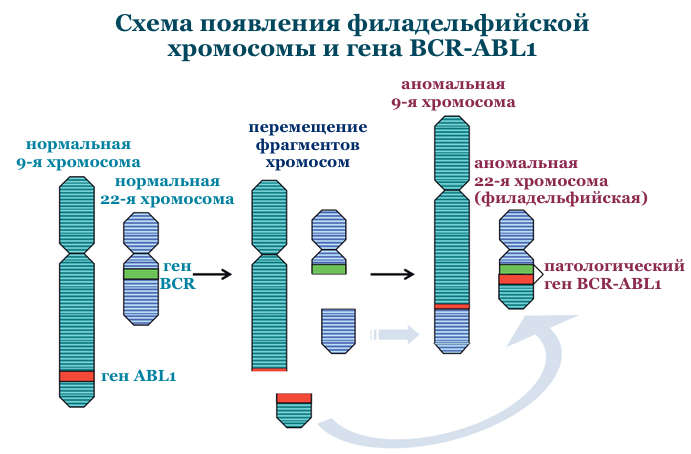
На рисунке представлена схема данной транслокации. Участки 9-й и 22-й хромосом меняются местами и образуется мутантный белок BCR-ABL, который активирует сигнальный каскад, контролирующий клеточный цикл, ускоряя деление клеток.
Для определения таких транслокаций используется флюресцентный микроскоп.
Что такое цитостатическая противоопухолевая терапия?
После завершения диагностики заболеваний врач определяет план лечения. Традиционно в него включается противоопухолевая химиотерапия, которая воздействует на быстро делящиеся клетки, в первую очередь – опухолевые, и предотвращает их развитие.
Противоопухолевые препараты делятся по принадлежности к химическому классу и механизму воздействия на клетки.
Антиметаболиты — препараты, которые внешне очень схожи с человеческими белковыми веществами, участвующими в жизнедеятельности клеток. Но, в отличие от естественных белков, их участие приводит к клеточной гибели. Например, метотрексат —аналог фолиевой кислоты, который участвует вместо нее в процессе синтеза ДНК и нарушает пролиферацию (размножение) опухолевых клеток.
Цитостатики растительного происхождения. Это препараты, получаемые из растительного вещества в лабораторных условиях. Они также нарушают процессы деления опухолевых клеток.
Примеры цитостатиков растильного происхождения:
- Алкалоиды барвинка розового — винбластин, винкристин;
- Алкалоиды тисового дерева (таксаны) — паклитаксел, доцетаксел;
- Подофиллотоксины, выделяемые из подофила щитовидного, этопозид, тенипозид.
Алкилирующие цитостатики. Это препараты, основанные на соединениях различных химических групп. Механизм действия алкилирующих цитостатиков заключается в том, что они нарушают структуру ДНК, запутывают ее нити и образуют внеплановые связки с ними. В итоге опухолевые клетки не могут делиться, и запускается процесс их гибели.
Противоопухолевые антибиотики. По химическому происхождению это такие же антибактериальные препараты, что используются для борьбы с воспалениями и инфекциями. Они не влияют на бактериальную флору, но уничтожают опухолевые клетки.
Почему возникает токсичность химиотерапии?
Токсические реакции обусловлены повреждением здоровых, быстро пролиферирующих (делящимся) клеток, которые, как правило, очень чувствительных к цитостатикам.
Токсическое воздействие на костный мозг выражается в постепенном замедлении скорости восстановления кроветворения, активная ткань может замещаться соединительной и жировой, а в анализах крови снижается уровень всех форменных элементов.
Слизистые оболочки реагируют воспалением, что проявляется стоматитом, колитом, энтеритом, пульмонитом и воспалением венозного эндотелия.
Токсическое воздействие на половые железы может привести к нарушению сперматогенеза и прекращением менструаций.
Также могут наблюдаться изменения придатков кожи – выпадение волос (алопеция), изменение структуры ногтей.
Протокол химиотерапии. Что такое блок химиотерапии?
Протокол лечения – это документ, который включает в себя руководство по диагностике, лечению и наблюдению пациентов с определенным гематологическим заболеванием. Протокол разрабатывают врачи-исследователи и врачи общей практики. Наименование протокола включает в себя название заболевания, которому посвящен этот протокол, название исследовательской группы и год, когда этот протокол был опубликован.
Например, название «ОЛЛ-МБ-2015» – означает, что протокол предназначен для лечения острого лимфобластного лейкоза и разработан группой МБ («Москва-Берлин»/ «Moscow-Berlin») в 2015 году.
Блок химиотерапии— это часть протокола лечения, содержащая информацию о комбинациях химиопрепаратов, которые эффективны против определенного онкологического заболевания. Обычно термин «блоковая терапия» используется при лечении лейкозов, когда в короткий промежуток времени необходимо провести высокодозное лечение.
В случае, если лейкоз прогностически благоприятный, то есть генетика этого лейкоза хорошая, может использоваться термин «поддерживающая терапия» — применение небольших доз препаратов в течение нескольких лет.
Этапы лечения острого лейкоза обычно называют по-другому — индукция, ремиссия (получение противоопухолевого ответа), консолидация (закрепление) и др.
Если речь идет о лейкозах высокой группы риска, то здесь в качестве консолидационного лечения используется трансплантация костного мозга.
Как проводится трансплантация костного мозга? Кому она может быть показана?
Трансплантация костного мозга – это процедура, при которой пациенту после проведения лекарственного противоопухолевого лечения вводится предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови. Показания к трансплантации определяются исключительно врачом.
Как проводится трансплантация костного мозга?
1) Забор стволовых клеток крови у донора ИЛИ у самого пациента (аферез клеток крови), их заготовка;
2) Репрессия (угнетение) и/или уничтожение (миелоабляция) кроветворных клеток пациента с целью уничтожения остаточного пула опухолевых клеток (химиотерапевтический режим кондиционирования);
3) Реинфузия стволовых клеток пациента пациенту ИЛИ инфузия стволовых клеток донора пациенту.
ВАЖНО!
- Трансплантация костного мозга – это нехирургическая процедура!
- Стволовые клетки крови трансплантируются путем внутривенного введения;
После завершения химиотерапии трансплантация показана не всем пациентам!
Виды трансплантации костного мозга
- Аутологичная – используются собственные клетки пациента. Показана при заболеваниях, НЕ ВОВЛЕКАЮЩИХ стволовую клетку и комитированные предшественники (лимфомы, где мутация происходит на уровне лимфатического узла);
- Аллогенная – используются клетки совместимого донора. Показана при заболеваниях, ВОВЛЕКАЮЩИХ комитированные предшественники или стволовую клетку (лейкозы, где мутация в стволовой клетке или предшественнике лимфо-миелопоэза).
Трансплантация костного мозга — методологически непростая процедура, поэтому важно максимально тщательно подобрать донора. Он должен быть абсолютно совместим с реципиентом (пациентом) на генетическом уровне.
Как найти донора костного мозга?
Когда в учреждение поступает человек с диагнозом острым лейкозом, специалисты понимают, что пациенту в перспективе нужна будет аллогенная трансплантация костного мозга. Поэтому у больного берется кровь и начинается поиск донора.
В первую очередь врачи рассматривают возможность трансплантации костного мозга от родственников. Если это невозможно, то специалисты ищут другие варианты решения задачи.
В настоящее время существует российский регистр доноров. В регистре состоят люди, которые добровольно дали согласие на то, чтобы поделиться своим здоровым костным мозгом с пациентами, которые нуждаются в трансплантации костного мозга.
Преимущество российского регистра в том, что состоящие в нем доноры проживают на одной территории с реципиентами и имеют большое количество генетических сходств.
Кто может стать донором костного мозга?
Донором может стать любой здоровый человек в возрасте от 18 лет до 55 лет, у которого нет хронических, тяжелых или инфекционных заболеваний. Чтобы стать донором, необходимо обратиться на ближайшую станцию переливания крови – ее сотрудники свяжут добровольца с центрами работы с донорами клеток крови и костного мозга.
От чего зависит успех лечения?
Успех лечения зависит от доверия между врачом и пациентом.
Комплаенс (англ. compliance – согласие, соответствие) – это добровольное следование пациента предписанному ему режиму лечения. Комплаенс включает в себя четыре пункта:
- пациент вовремя принимает лекарство;
- пациент принимает лекарство в полной дозе;
- пациент соблюдает рекомендации по диете и образу жизни;
- полностью осознает необходимость временных ограничений и приветствует их.
Соблюдение этих принципов может привести к благополучному исходу в борьбе против рака.
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Если вам понравилась статья:
- оставьте комментарий ниже;
- поделитесь в социальных сетях через удобные кнопки:





Замечательная статья! Огромное спасибо! Страшней онкологии только отсутствие знаний о болезни, если болеет родной человек..
Спасибо Ирина Валерьевна за статью! Для пациентов очень важно знать и понимать о своей болезни и принципах лечения