Содержание:
Онкологическая заболеваемость среди подростков и молодых людей растет во всем мире. Ее структура отличается от таковой в других возрастных группах – по мере взросления преобладают либо детские опухоли, либо злокачественные новообразования, свойственные взрослым. Рак у подростков имеет целый ряд отличий от других возрастных групп, и недостаток знаний о нюансах применения противоопухолевых лекарственных средств у подростков и биологии опухолей в этой группе, недостаток внимания к психологическим проблемам зачастую приводят к неудачам терапии. За последние 30 лет существенного прогресса в лечении подросткового рака достигнуто не было, и решение этой проблемы требует поиска новых подходов.
В России подростки от 15 до 19 лет составляют 4,7% населения, а молодые взрослые от 20 до 29 лет – 15%, при этом заболеваемость злокачественными опухолями у них в 1,3 и 4,0 раза выше, чем у детей. Во многих экономически развитых странах около 2% опухолей приходится на возраст 15-30 лет. Злокачественные новообразования в этой группе являются второй по распространенности причиной смерти после травм.
Эпидемиология
В США и Европе онкологическая заболеваемость у молодых людей составляет от 15 до 27 случаев на 100 тыс. населения, ежегодно увеличиваясь на 0,9%. Высокий прирост отмечен для меланомы – на 5%, неходжкинской лимфомы и опухолей яичка – по 2%. Среди подростков от 15 до 19 лет наиболее распространены опухоли яичек (15%) и лимфома Ходжкина (ЛХ) (16%), далее в порядке убывания следуют опухоли центральной нервной системы (ЦНС), неходжкинские лимфомы, рак щитовидной железы, злокачественная меланома и острый лимфобластный лейкоз (ОЛЛ) (рис. 1). Они составляют более двух третей от общего количества злокачественных новообразований.
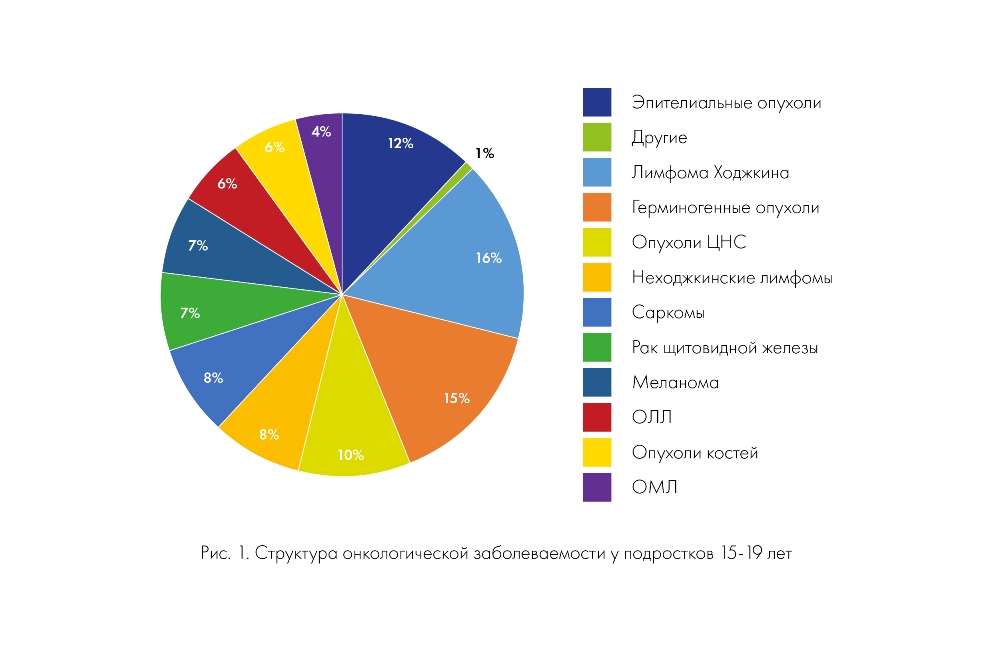
Среди герминогенных опухолей у юношей чаще встречаются несеминомы, а в большинстве случаев лимфомы Ходжкина отмечен подтип нодулярного склероза. У 15-19-летних пациентов на долю неэпителиальных новообразований приходится 88% всех случаев злокачественных процессов, в то время как эпителиальные опухоли составляют лишь 12%, при этом заболеваемость раком с возрастом неуклонно увеличивается.
Структура онкологической заболеваемости у молодых людей значительно отличается от детской – такие эмбриональные опухоли, как нефробластома, нейробластома, медуллобластома, ретинобластома и гепатобластома практически не встречаются. Рабдомиосаркома составляет лишь четверть сарком мягких тканей наряду с синовиальной саркомой, липосаркомой и фиброзной гистиоцитомой. Острый лимфобластный лейкоз встречается в 6% случаев в отличие от детей, у которых его удельный вес составляет 30%. Среди пациентов в возрастной группе от 20 до 30 лет наиболее распространены ЛХ, герминогенные опухоли, меланома, опухоли центральной нервной системы, костей и саркомы мягких тканей (рис. 2).
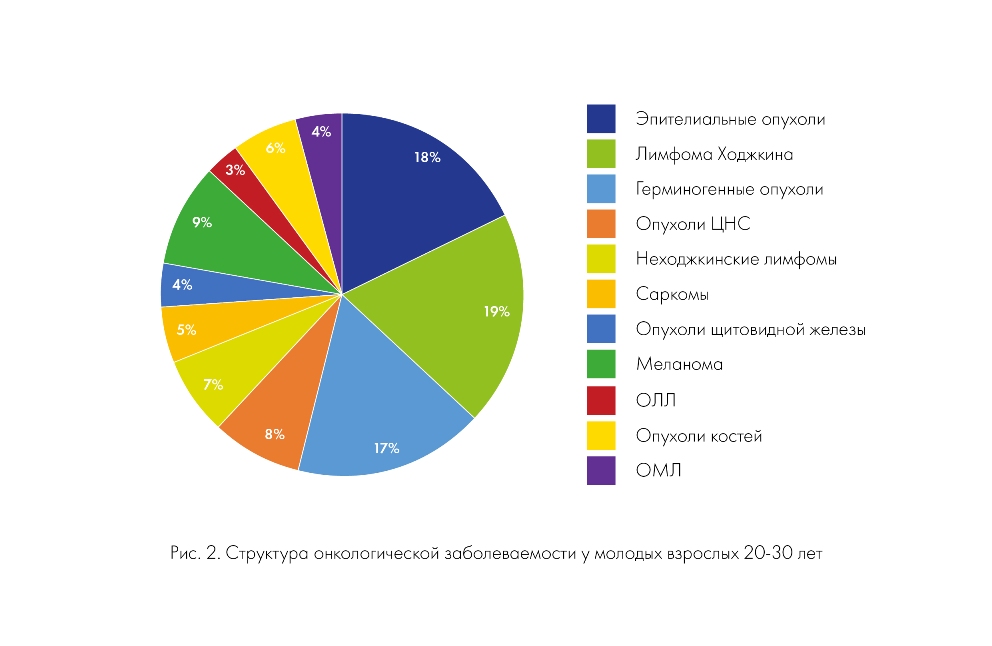
Пик заболеваемости Лимфомой Ходжкина и опухолями гонад приходится на возраст 20-30 лет. Новообразования яичников у 15-19-летних в 60% случаев являются герминогенными опухолями, тогда как у 20-24-летних девушек в 70% случаев это рак. У подростков и молодых людей крайне редко встречается рак органов пищеварения и мочеполового тракта, распространенный у пожилых людей.
Показатели заболеваемости злокачественными новообразованиями по возрасту в России представлены на рис. 3.
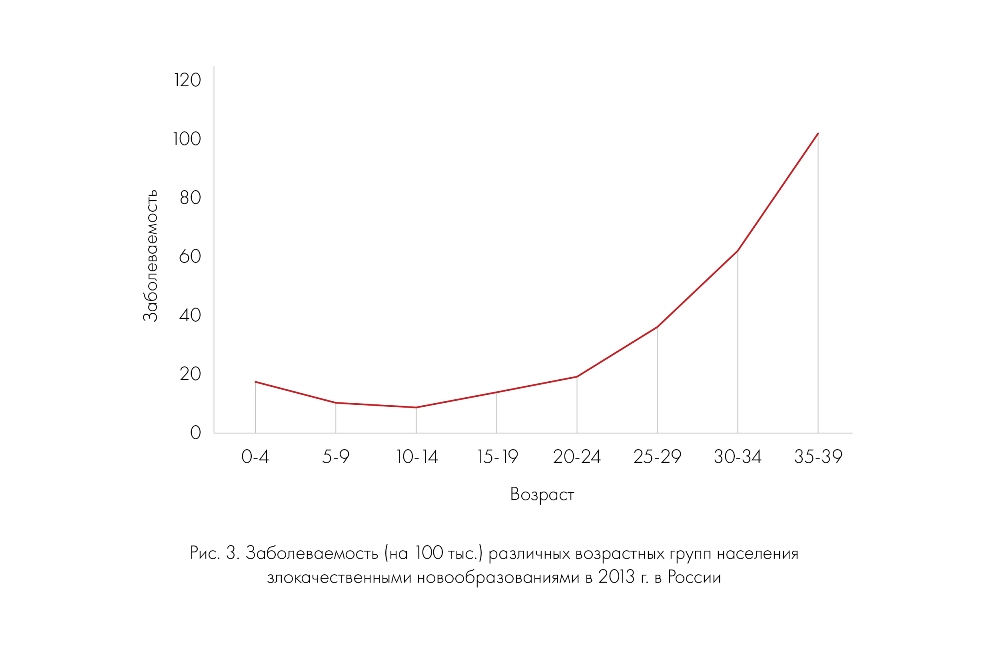
Минимальный уровень отмечен у школьников 10-14 лет, составляя 9,07 на 100 тыс. населения. С возрастом заболеваемость начинает расти, достигая у молодых взрослых значения 35,66 на 100 тыс.
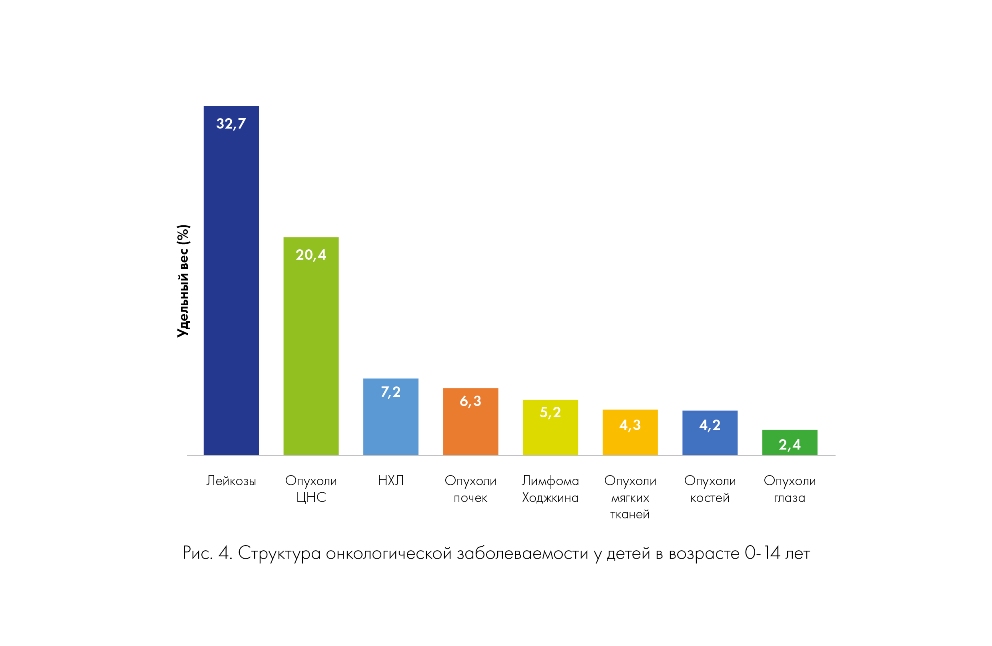
Структура онкологических заболеваний у детей, подростков и молодых взрослых в России мало отличается от общемировых показателей (рис. 4, 5). У детей преобладают лейкозы (36,8%), частота которых с возрастом снижается, достигая минимума у молодых взрослых 25-29 лет (3,7%). У юношей и девушек значительно реже, чем у детей, встречаются опухоли центральной нервной системы. Пик заболеваемости ЛХ и опухолями костей приходится на возраст 15-19 лет (19,62 и 9,36% соответственно).
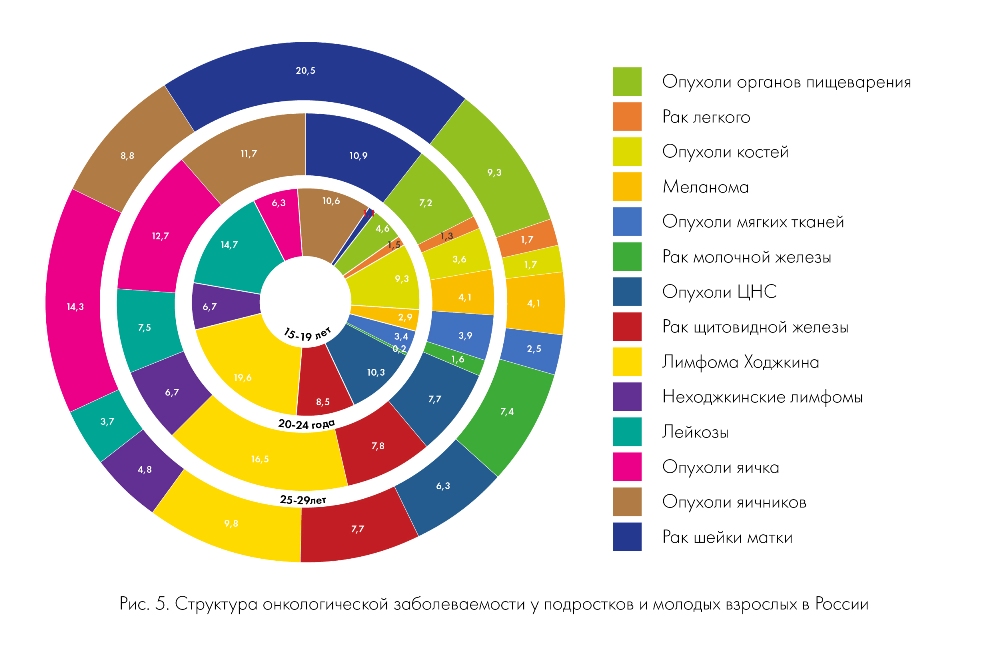
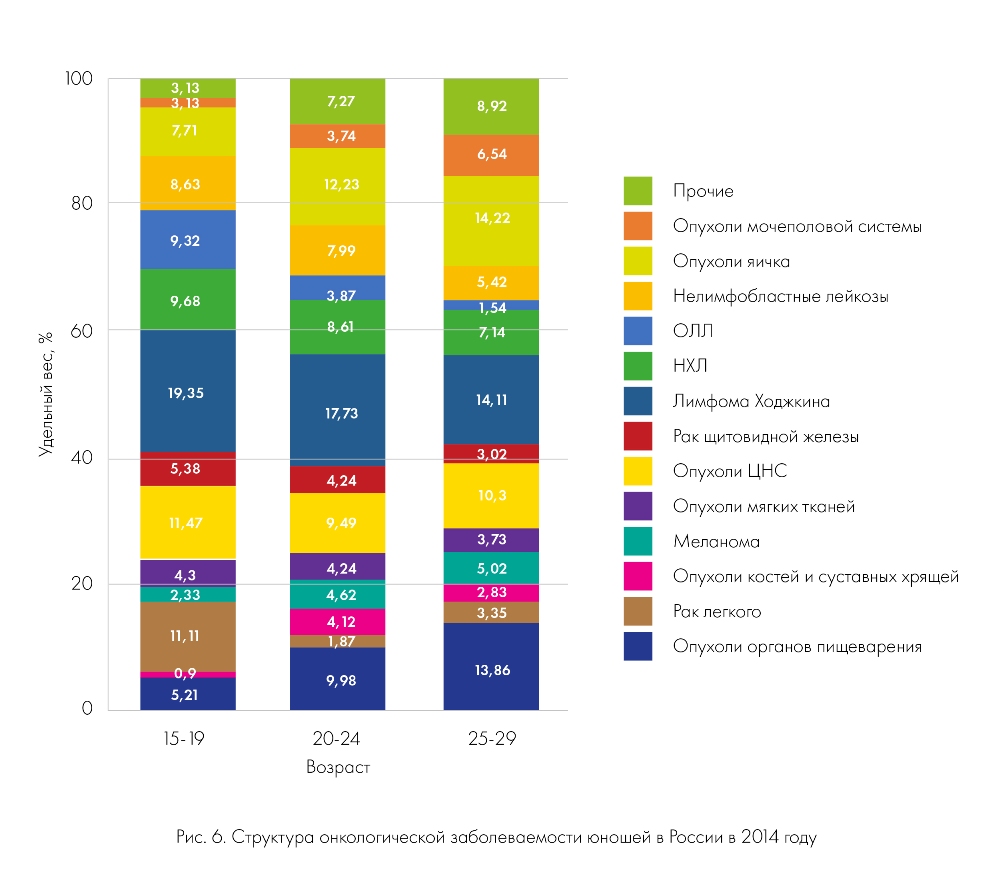
Структура онкологической заболеваемости значительно отличается в зависимости от пола. У юношей-подростков в возрасте 15-19 лет в структуре онкологической заболеваемости доминирует ЛХ (19,35%), второе место делят между собой опухоли ЦНС и опухоли костей и суставов (11,47 и 11,11% соответственно), на третьем месте – НХЛ (9,68%) и ОЛЛ (9,32%).
В возрасте 20-24 года удельный вес лимфомы Ходжкина остается наиболее высоким, составляя 17,73%. На второе место в структуре заболеваемости выходят опухоли яичка (12,23%). Значительно возрастает удельный вес опухолей органов пищеварения (9,98%), которые в этом возрасте встречаются с такой же частотой, как и опухоли ЦНС (9,49%). В два с половиной раза снижается в данной возрастной группе заболеваемость ОЛЛ и костно-суставными неоплазиями. Эта тенденция сохраняется и в старшей возрастной группе (25-29 лет), в которой заболеваемость ОЛЛ (1,54%) и опухолями костей (2,83%) достигает минимальных значений. Первое место по частоте встречаемости делят между собой новообразования гонад и ЛХ (14,22 и 14,11% соответственно).
Повышается удельный вес эпителиальных опухолей, в частности опухолей желудочно-кишечного тракта (находятся на втором месте по частоте встречаемости, составляя 13,86%). Заболеваемость раком легкого (3,35%) и опухолями мочеполовой системы (6,54%) возрастает примерно в 4 раза по сравнению с подростковым возрастом (0,9 и 1,48% соответственно).
На третьем месте у молодых людей в возрасте 25-29 лет находятся новообразования ЦНС (10.3%). Следует отметить, что опухоли ЦНС встречаются с примерно равной частотой во все возрастные периоды, составляя десятую часть в структуре онкологической заболеваемости (рис. 6).
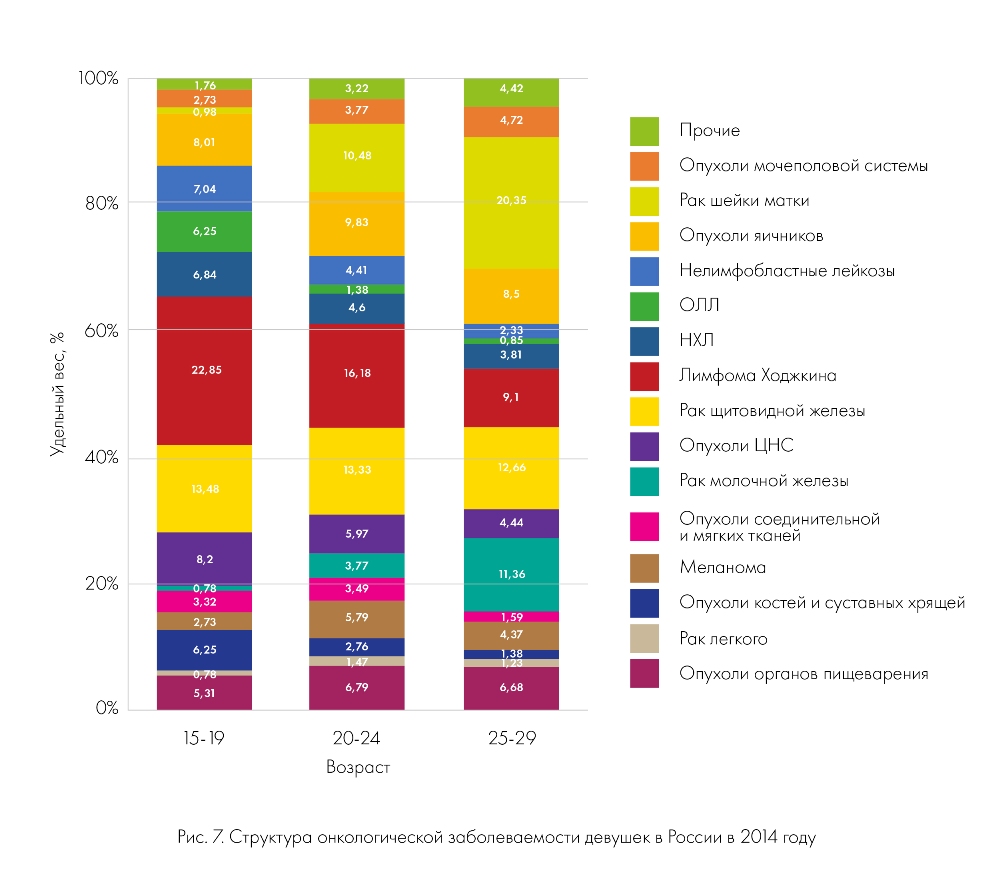
У девочек-подростков в возрасте 15-19 лет ЛХ занимает в структуре онкологической заболеваемости первое место (22,85%). На втором месте находится рак щитовидной железы (РЩЖ) – 13,48%, на третьем – опухоли мягких тканей и яичников (8,2 и 8% соответственно). Рак шейки матки, молочной железы и легкого практически не встречается.
У девушек 20-24 лет лидирует заболеваемость лимфомой Ходжкина, однако удельный вес ее снижается, составляя 16,18%. Заболеваемость РЩЖ остается неизменной (13,33%), занимая второе место по частоте встречаемости. В десять раз возрастает заболеваемость раком шейки матки (10,48% против 0,98% в возрасте 15-19 лет), который в структуре онкопатологии встает третье место наравне с опухолями яичников (9,83%). Лимфопролиферативные заболевания и опухоли костей встречаются у девушек в два раза реже, чем у их сверстников-юношей.
У молодых женщин 25-29 лет пятую часть всей онкологической патологии составляет рак шейки матки, достигая 20,35%. Заболеваемость данной неоплазией возрастает по сравнению с возрастом 15-19 лет в 20 раз. На втором месте находится РЩЖ (12,66%), удельный вес которого остается неизменным во всех возрастных группах. Следует отметить, что РЩЖ у женщин встречается в 3-4 раза чаще, чем у мужчин того же возраста. Третье место занимает рак молочной железы (11,36%), удельный вес которого увеличивается в 14 раз по сравнению с возрастом 15-19 лет (0,78%). Частота опухолей гонад неизменна во всех возрастных группах и составляет от 8 до 9,8%.
У девушек и молодых женщин в возрасте от 20 до 29 лет в полтора-два раза ниже удельный вес опухолей ЦНС, органов пищеварения, костей и суставных хрящей, соединительной и мягких тканей, чем у их сверстников (рис. 7).
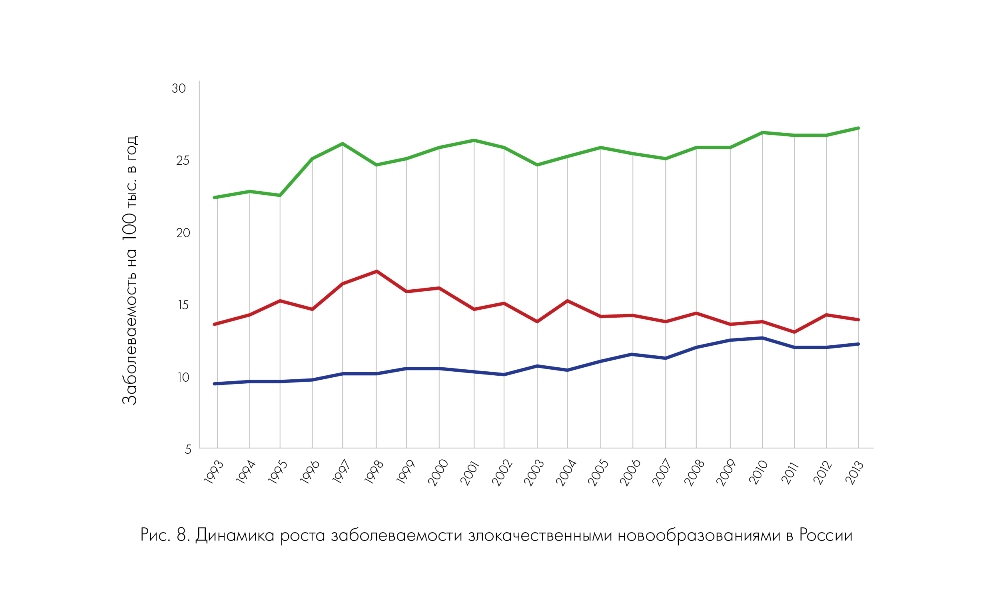
В период с 1993 по 2013 гг. в России отмечен рост заболеваемости злокачественными новообразованиями у детей от 0 до 14 лет и молодых взрослых в возрасте 20-29 лет (рис. 8). В группе подросткового возраста подъем заболеваемости произошел в 1997-2001 гг., в дальнейшем цифры стабилизировались на уровне 14-15 случаев на 100 тыс. населения в год.
Наибольший прирост заболеваемости в последние пять лет произошел именно в группе молодых взрослых, достигая в возрасте 30-39 лет 7,7% (рис. 9).
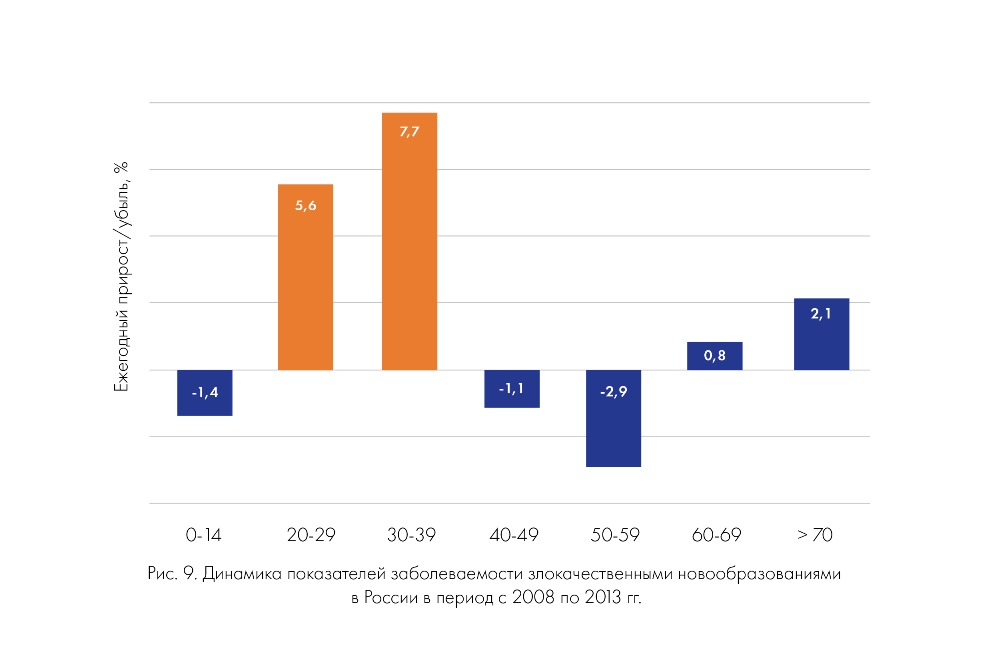
Подобные тенденции прослеживаются во многих экономически развитых странах.
Факторы риска
В настоящее время установлены экологические, алиментарные (связанные с питанием), гормональные, инфекционные и генетические факторы риска для многих типов онкологических заболеваний, возникающих у подростков. В отличие от пожилых людей опухоли у подростков и молодых взрослых в большей степени обусловлены генетической предрасположенностью и воздействием модифицирующих факторов риска на ранних этапах жизни.
Развитие неэпителиального рака с большой вероятностью связано с вирусной инфекцией, радиацией, генетическими факторами, а также влиянием многочисленных химических канцерогенов окружающей среды. Тем не менее, большинство форм рака у подростков встречаются в виде спорадических, т.е. случайных событий с неизвестными причинами возникновения. А такие орфанные, т.е. редкие синдромы, как Ли-Фраумени, пигментная ксеродерма, атаксия-телеангиэктазия, синдромы Тернера и Беквита-Видемана связаны с повышенным риском развития рака.
Вероятность возникновения острых лимфобластных и нелимфобластных лейкозов среди людей с синдромом Дауна в возрасте от 5 до 29 лет примерно в 10 раз выше, чем в остальной группе населения.
Нейрофиброматоз (обычно 1-го типа) несет повышенный риск для опухолей центральной нервной системы и сарком мягких тканей.
Наследственный синдром Ли-Фраумени, заключающийся во врожденной предрасположенности к развитию различных новообразований, в первую очередь остеогенных сарком, сарком мягких тканей, рака молочной железы, лейкемии, опухолей мозга, адренокортикальных карцином характеризуется ранним возникновением опухолей у подростков.
Различные виды опухолей, особенно саркомы у молодых людей, чаще встречаются в составе семейного ракового синдрома (синдрома Линча).
Инфицирование вирусом папилломы человека является установленным фактором риска развития большинства форм рака шейки матки.
Доказана роль вируса гепатита В как этиологического фактора гепатоцеллюлярной карциномы.
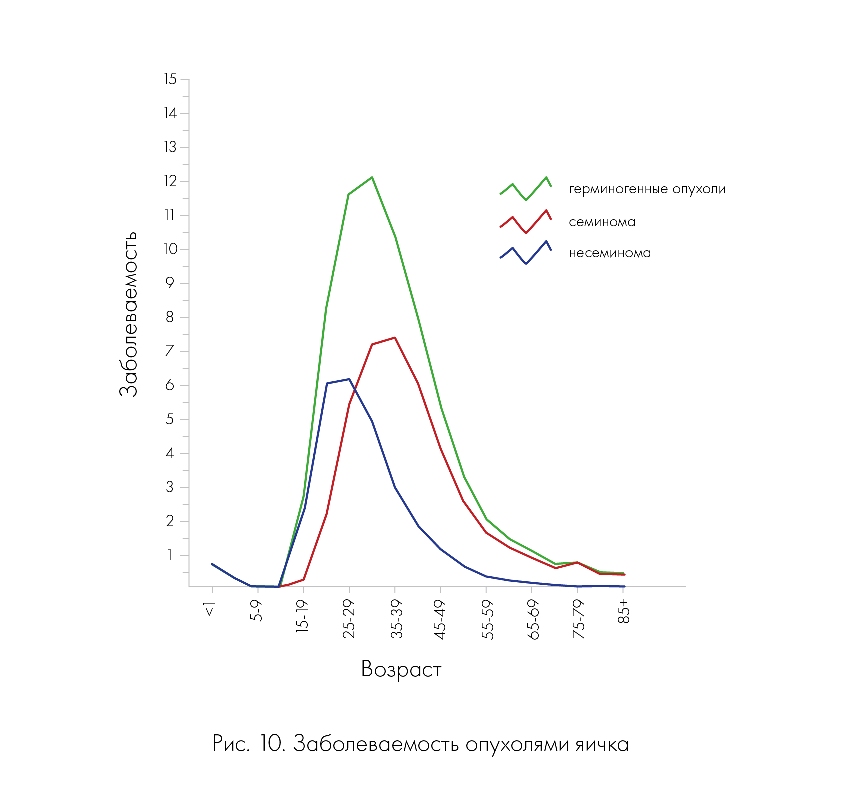
Крипторхизм, гидроцеле и паховая грыжа были последовательно определены как факторы рака яичка. Опухоли яичка имеют пик в подростковом возрасте. Восемьдесят четыре процента герминогенных опухолей встречается среди мужчин в возрасте от 15 до 44 лет, 15% – приходится на возраст 45 лет и старше и только 1% – на возраст младше 15 лет (рис. 10).
Щитовидная железа чувствительна к воздействию ионизирующего излучения, при этом вероятность развития рака повышается при облучении в раннем возрасте.
Эффективность лечения
Хотя общая выживаемость у больных с опухолями в последние годы резко возросла, результаты у подростков оказались менее впечатляющими. В 70-х гг. прошлого века показатели общей выживаемости больных раком подростков были выше, чем у детей и пожилых пациентов, однако это преимущество снижалось, и было утеряно в середине 90-х годов.
Популяционный анализ эффективности лечения злокачественных опухолей в США за последнюю четверть века показал, что при более высоких темпах роста заболеваемости раком у подростков и молодых взрослых в возрасте от 15 до 45 лет значительных успехов в улучшении выживаемости в этой возрастной категории не достигнуто. В частности, среднегодовое улучшение 5-летней выживаемости превысило 1,5% у детей младше 15 лет и взрослых старше 50 лет. Однако у лиц в возрасте 15-24 лет улучшение отмечено в среднем менее чем на 0,5%, а в возрасте 25-34 лет вообще не было никакого заметного прогресса.
Ввиду отсутствия популяционного канцер-регистра в России, позволяющего оценить пятилетнюю общую выживаемость, судить о динамике этого показателя на территории всей страны не представляется возможным. Ниже представлен график (рис. 11), иллюстрирующий изменение смертности у больных разных возрастных групп, на основании которого можно косвенно судить об улучшении выживаемости. Показатель смертности в группе молодых взрослых снизился на 1/3 с 1993 года, у более старших – на четверть. Однако, как видно на графике, в течение последних пяти лет существенного снижения смертности не произошло в отличие от пациентов детского возраста и более старших возрастных групп, где этот показатель за пять лет достигает 10%.
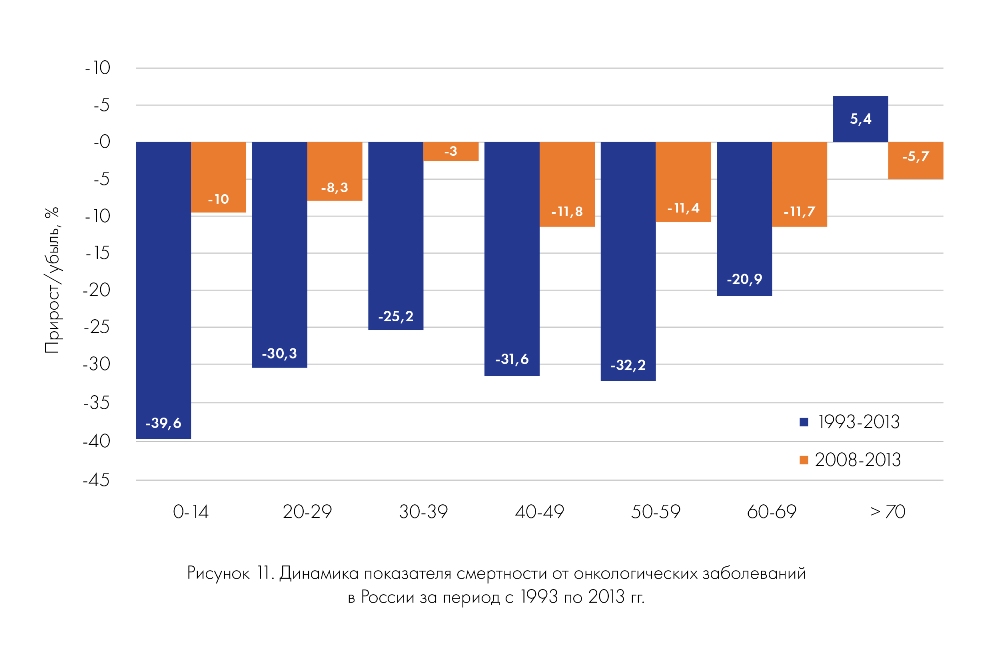
Причины различий в результатах лечения подростковой и других возрастных групп не совсем ясны и, скорее всего, зависят от многих факторов.
Биологические особенности опухолей
Одно из объяснений отсутствия прогресса в выживаемости у подростков и молодых взрослых заключается в том, что биологические характеристики злокачественных новообразований у молодых и пожилых людей отличаются. Это утверждение может быть проиллюстрировано на примере рака молочной железы (РМЖ). Среди девушек на рак молочной железы приходится 7%, при этом в данной возрастной группе отмечается самая низкая пятилетняя выживаемость – 80,2%, в то время как в возрасте 30-39 лет и 40-49 лет выживаемость составляет 83,4% и 88,9% соответственно. Рак молочной железы встречается у юных женщин редко, составляя лишь 1% от всего РМЖ в возрасте до 30 лет. В структуре раковых заболеваний у девушек в возрасте до 20 лет опухоли молочной железы диагностируются в 2% случаев. «Молодой» рак молочной железы отличается более агрессивным фенотипом: характеризуется отсутствием экспрессии рецепторов эстрогенов (ER — estrogen receptor) и прогестерона (PgR — progesterone receptor); он чаще ЕR и РgR негативен, имеет инвазивный рост и высокую степень злокачественности (grade 3). «Тройной негативный» (ER(-)/PgR(-)/HER-2/neu [Human Epidermal growth factor Receptor – рецептор эпидермального фактора роста](-)) фенотип, отличающийся наибольшей летальностью, особенно характерен для девушек. Риск развития местного рецидива в этом возрасте после органосохраняющих операций в 9 раз выше, чем у пожилых. Прогресс в улучшении выживаемости больных РМЖ с 1974 г. в наименьшей степени коснулся молодых женщин. Доказано, что возраст до 35 лет является мощным независимым прогностическим фактором неблагоприятного исхода. На рис. 12 представлена общая выживаемость больных раком молочной железы в зависимости от возраста. Самая низкая общая выживаемость отмечается у женщин 25-29 лет.
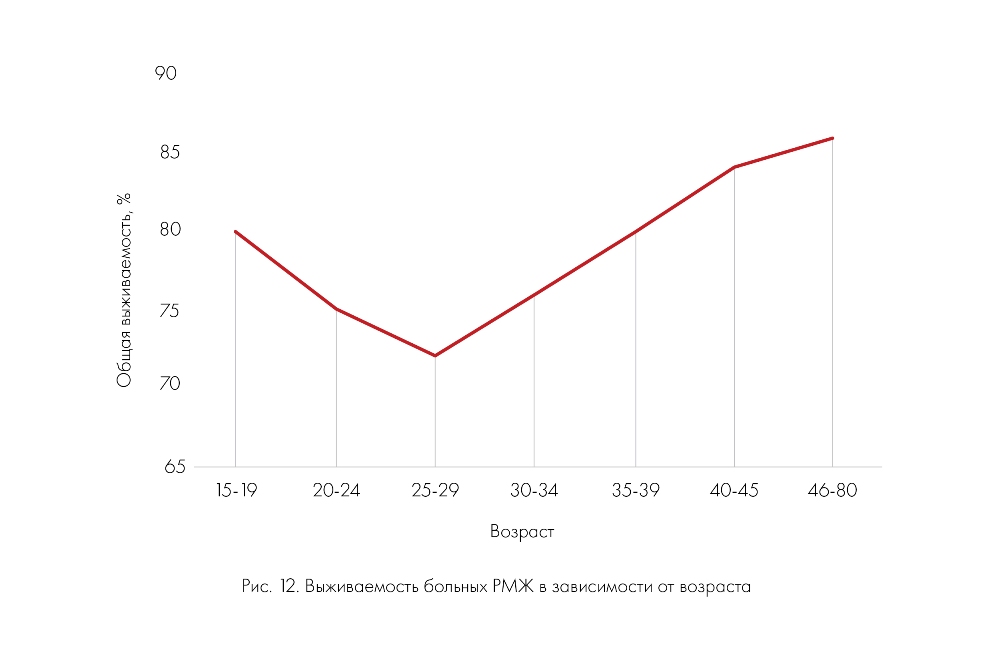
«Молодой» рак молочной железы является ярким примером опухоли, требующей иного подхода к терапии из-за биологических отличий, связанных с возрастом.
Социальные и психологические факторы
Подростковый возраст – это период экспериментов с употреблением табака, алкоголя и наркотических веществ, многие из которых могут повлиять на метаболизм химиопрепаратов. Нередки случаи несоблюдения подростками режима проводимого лечения или полного отказа от него в силу психологических особенностей этого возрастного периода. Также играет роль социальная пассивность и стремление к отрицанию очевидных проблем в подростковой среде.
При сравнении показателей летальности по полу было выявлено, что мужской пол является неблагоприятным фактором риска у пациентов 15-40 лет. Женщины, как известно, имеют более благоприятный прогноз заболевания в связи с преобладанием у них локализованных стадий.
Выбор тактики лечения
Другой причиной неудовлетворительных результатов лечения является низкий процент включения подростков и молодых взрослых в многоцентровые исследовательские протоколы лечения опухолей, отмечаемый во всем мире. По-видимому, немаловажную роль в эффективности терапии играет лечение пациентов по «детским» либо «взрослым» программам.
К примеру, стандарты лечения лимфомы Ходжкина для подростков не установлены до сих пор, поскольку они могут получать терапию как в педиатрических, так и во взрослых клиниках, практикующих разные технологии. Оба подхода считаются эффективными, так как обеспечивают длительные ремиссии и высокие показатели общей выживаемости. Современные режимы химиолучевой терапии позволяют излечить приблизительно 80% больных. Однако результаты некоторых исследований свидетельствуют о худшем прогнозе у подростков, леченных по взрослым программам.
Различия между «детскими» и «взрослыми» подходами к лечению существенны. Согласно «взрослым» программам проводится стратификация пациентов на ранние (I и II стадии) и распространенные (III и IV стадии) формы. Подростки с распространенными стадиями, придерживаясь данной стратегии, получают 6 циклов полихимиотерапии по схеме ABVD, в то время как в педиатрических протоколах предусмотрена альтернация других схем с ABVD с целью уменьшения риска пульмо- и кардиотоксичности, а также введение в программу лечения консолидирующего облучения.
Не существует каких-либо рандомизированных исследований, касающихся подростков и молодых взрослых с ЛХ. Было лишь доказано, что выживаемость этой категории пациентов выше, чем больных более старшего возраста. Однако при сравнении с отдаленными результатами у детей, пятилетняя выживаемость которых превышает 90%, подобных цифр у подростков получено не было.
J. Wolfson и соавт. (2014) проанализировали выживаемость 560 детей и 784 подростков и молодых взрослых с опухолями центральной нервной системы, получавших лечение в период с 1998 по 2008 гг. У пациентов всех возрастных групп с опухолями Grade II по классификации ВОЗ результаты лечения были хуже, если они не включались в исследовательские протоколы. Среди включенных в исследование больных выживаемость у молодых людей была хуже, чем у детей.
Особенности воздействия лекарственных препаратов
Известно, что концентрация препарата в крови и длительность его воздействия во многом определяют эффективность и токсичность противоопухолевой терапии. Эти параметры хорошо изучены во взрослой популяции. Однако подростки во время процесса роста и полового созревания переживают разнообразные физиологические и физические изменения, которые потенциально могут повлиять на распределение лекарственных средств. Увеличение роста и веса во время подросткового ростового скачка сопровождается изменениями в составе тела. Для девушек характерно большее увеличение жировой массы, в то время как у юношей преобладает прирост мышц. При этом в последние годы отмечено повышение индекса массы тела среди подростков. Доказано, что подростки с высоким индексом массы тела имеют худшие результаты при лечении острого миелобластного лейкоза. Ожирение не только может нарушить распределение препарата в организме из-за изменения клиренса лекарственного вещества, но и является дополнительным фактором развития лекарственных осложнений.
Обсуждается активация секреции гормона роста, инсулиноподобного фактора роста-1 (ИПФР-1) и опосредованное влияние их на метаболизм лекарственных препаратов через воздействие на половые гормоны и, в конечном итоге, активность печеночных ферментов.
Отдаленные последствия
Благодаря достижениям современной онкологии общая выживаемость выросла во всех возрастных группах, и многие больные проживают несколько десятилетий после лечения, что позволяет проводить исследования отдаленных последствий химио- и лучевой терапии. У молодых людей, находящихся в периоде «вытягивания» и полового созревания, по сравнению с детьми не встречается нарушение роста, обусловленное воздействием ионизирующего излучения. Однако у пациентов всех возрастов повышен риск развития антрациклиновой кардиотоксичности и радиоиндуцированных вторых солидных опухолей.
Использование в схемах полихимиотерапии блеомицина, высоких доз циклофосфамида, нитрозомочевины, бусульфана и облучение легких нередко служат причиной развития пневмофиброза. Облучение центральной нервной системы приводит к развитию таких осложнений, как церебральная атрофия, демиелинизирующие заболевания, лейкоэнцефалопатия и нейрокогнитивные расстройства. Частота развития осложнений варьирует от 30 до 70% в зависимости от возраста, дозы и сочетания с нейротоксическими препаратами (ифосфамид, метотрексат, цитарабин).
Облучение средостения у девочек в возрасте 10-16 лет ведет к повышению риска развития рака молочной железы по сравнению с девочками младшего возраста, что подтверждает теорию индуцирования ионизирующим излучением солидных опухолей в растущей ткани молочной железы. Цифры заболеваемости раком молочной железы (13,9% в 40 лет и 20,1% в 45 лет) являются поводом для пересмотра суммарных доз и полей облучения в зависимости от возраста пациентки.
Еще одним последствием химио- и лучевой терапии у молодых людей является нарушение фертильности. Частота, степень и продолжительность бесплодия зависят от дозы и механизма действия препарата, возраста пациента и особенностей самой опухоли. Частота бесплодия варьирует от 20 до 90% у мужчин и от 15 до 75% у женщин. Облучение яичек, яичников и гипоталамо-гипофизарной области может привести к необратимой стерильности. Создание банка половых клеток, проведение заместительной гормональной терапии оказывают значительное влияние на улучшение качества жизни молодых людей.
По мере увеличения числа пациентов, излеченных от злокачественных заболеваний, стало очевидным, что за выздоровлением от первичной опухоли стоит целый ряд отдаленных последствий терапии. Через 15-20 лет после проведения лечения у пациентов намного больше шансов умереть от вторичных опухолей и сердечно-сосудистых заболеваний, чем у их сверстников.
Выводы
Во всем мире отмечен рост заболеваемости злокачественными новообразованиями у молодых людей. Структура заболеваемости подростков и молодых взрослых отличается от таковой в других возрастных группах.
За последние 30 лет не было достигнуто существенного прогресса в лечении онкологических заболеваний у молодых пациентов в возрасте 15-29 лет. Причинами неудач терапии являются:
- отсутствие четкого понимания о выборе необходимой стратегии («детской» или «взрослой») при лечении различных неоплазий в данной возрастной группе;
- недостаток знаний об особенностях фармакокинетики и фармакодинамики противоопухолевых лекарственных средств у подростков;
- особенности биологии опухолей у молодых пациентов;
- недостаток внимания к психологическим особенностям переходного возраста, зачастую приводящим к невыполнению указаний врача.
Создание многоцентровых исследовательских групп по лечению злокачественных новообразований у подростков и молодых взрослых, более активное включение пациентов данной группы в исследования со временем позволят добиться лучших результатов выживаемости и снижения частоты отдаленных последствий у больных в возрасте 15-29 лет.
Список литературы
- Давыдов М.И., Аксель Е.М. Статистика злокачественных новообразований в России и странах СНГ в 2012 г. // Издательская группа РОНЦ. – – 226 с.
- Злокачественные новообразования в России в 2014 году (заболеваемость и смертность) // Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой — М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России. — — 250 c.
- Колыгин Б.А., Кулева С.А. Диагностика и лечение лимфомы Ходжкина // Спб, «Гиппократ», 2009. – 208 с.
- Колыгин Б.А., Кулева С.А. Последствия противоопухолевой терапии у детей // Спб, «Гиппократ», 2011. – 184 с.
- Петрова Г.В., Каприн А.Д., Грецова О.П., Старинский В.В. Злокачественные новообразования в России обзор статистической информации за 1993-2013 гг./ под общей редакцией чл.-корр. РАН, проф. А.Д. Каприна, проф. В.В. Старинского — М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИРЦ» Минздрава России, 2015. — 511 с.
- Aben K.K., van Gaal C., van Gils N.A. et al. Cancer in adolescents and young adults (15-29 years): a population-based study in the Netherlands 1989-2009 // Acta Oncol. – 2012. – Vol. 51(7). – 922-933.
- Anders C.K., Johnson R., Litton J. et al. Breast cancer before age 40 years // Semin. Oncol. – 2009. – Vol. 36(3). – Р. 237-249.
- Barr R.D., Holowaty E.J., Birch J.M. Classification schemes for tumors diagnosed in adolescents and young adults // – 2006. – Vol. 106. – P. 1425–1430.
- Barr, R. D., Ries, L. A. G., Lewis, D. R., Harlan, L. C., Keegan, T. H. M., Pollock, B. H., Bleyer, W. A. and for the US National Cancer Institute Science of Adolescent and Young Adult Oncology Epidemiology Working Group // Incidence and incidence trends of the most frequent cancers in adolescent and young adult Americans, including “nonmalignant/noninvasive” tumors. Cancer – 2016. — Vol. 122. – Р. 1000–1008.
- Bhatia S., Yasui Y., Robison L.L. et al. High risk of subsequent neoplasms continues with extended follow up of childhood Hodgkin disease: report from the Late Effects Study Group // J. Clin. Oncol. – – Vol. 21. – Р. 4386–4394.
- Birch J.M., Alston R.D., Kelsey A.M., Quinn M.J., Babb P., McNally R.J.Q. Classification and incidence of cancers in adolescents and young adults in England 1979–1997 // J. Cancer. – 2002. – Vol. 87(11). – P. 1267-1274.
- Bleyer A., Budd T., Montello M. et al. Adolescents and young adults with cancer // Cancer. – 2006. – V 107. – Р. 1645–1655.
- Bleyer A., O’Leary M., Barr R. at al. Cancer Epidemiology in Older Adolescents and Young Adults 15 to 29 Years of Age, Including SEER Incidence and Survival: 1975-2000 // National Cancer Institute, NIH Pub. No. 06-5767. Bethesda, MD. – – 218 p.
- Bleyer A.,Viny A., Barr R. Cancer in 15- to 29-year-olds by primary site // – 2006. – Vol. 6. – P. 590-601.
- Butow P., Palmer S., Pai A.et al. Review of adherence-related issues in adolescents and young adults with cancer // J. Clin. Oncol. – 2010. – Vol. 28. – P. 4800–4809.
- Dieckmann K.P., Pichlmeier U. Clinical epidemiology of testicular germ cell tumors // World J. Urol. – 2004. — 22(1). – Р. 2-14.
- Donaldson S.S., Hudson M.M., Lamborn K.R. VAMP and low-dose, involved-field radiation for children and adolescents with favorable, early-stage Hodgkin disease: results of a prospective clinical trial // J. Clin. Oncol. – 2002. – Vol. 20. – Р. 3081–3087.
- Eyre R., Feltbower R.G., James P.W. et al. The epidemiology of bone cancer in 0 — 39 year olds in northern England, 1981 — 2002 // BMC Cancer. – 2010. – Vol. 10. – P. 357.
- Ferrari A. Participation of adolescents with cancer in clinical trials // Cancer Treat. Rev. — 2013. – Vol. 33. – Р. 603 – 608.
- Haggar F. A.,Preen D.B., Pereira G. et al. Cancer Incidence and Mortality Trends in Australian Adolescents and Young Adults, 1982–2007 // BMC Cancer. – 2012. – Vol. 12. – P. 151-159.
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Если вам понравилась статья:
- оставьте комментарий ниже;
- поделитесь в социальных сетях через удобные кнопки: